腺相关病毒属微小病毒科( parvovirus),为无包膜的单链线状 DNA 病毒。AAV 的基因组约 4700bp,包括上下游两个开放读码框架(ORF),位于分别由 145 个核苷 酸组成的2 个反向末端重复序列(ITR)之间。基因组中有 3 个启动子(P5、P19 和 P40) 和 2 个开放阅读读框(ORF),rep 和 cap,如图 1 所示。rep 编码 4 个重叠的多功能蛋白,即 Rep78、Rep68、Rep52 和 Rep40,其中 Rep78 与 Rep68 参与 AAV 的复制与整合,Rep52 和 Rep40 具有解螺旋 酶和 ATP 酶活性,与 Rep78、Rep68 共同参与单链基因组的复制;cap 编码的 VP1、 VP2、VP3是装配成完整病毒所需要的衣壳蛋白,它们在 AAV病毒整合、复制和装配中其重要作用。
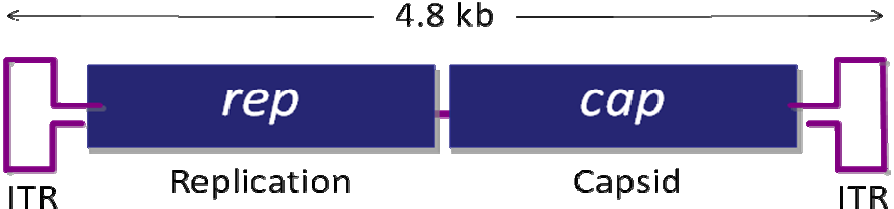
图1. AAV 基因组结构
二、腺相关病毒的优点
1. 安全性高:迄今从未发现野生型AAV 对人体致病,重组AAV 基因组序列上去 除了大部分的野生型AAV 基因组元件,进一步保证了安全性;
2. 免疫原性低:AAV2 的基因组仅 4681 个核苷酸,便于用常规的重组 DNA技术 进行操作,而且进行动物实验时造成的免疫反应小;
3. 宿主范围广:能感染分裂细胞和非分裂细胞;
4. 表达稳定:能介导基因的长期稳定表达;
5. 物理性质稳定:在60℃不能被灭活,能抗氯仿;
三、重组腺相关病毒载体系统简介
AAV是一种复制缺陷型微小病毒,其增殖复制需要腺病毒或疱疹病毒的辅助。 AAV无辅助病毒系统(AAV Helper-Free System)可以在无辅助病毒的条件下生产出 重组腺相关病毒。在AAV Helper-Free System 中,生产具有感染性的AAV 病毒颗粒所 需的腺病毒基因产物(如:E2A,E4 等基因)大部分由pHelper 质粒提供,其余的腺 病毒基因产物由稳定表达腺病毒E1基因的AAV-293宿主细胞提供。AAV-293细胞是 HEK293细胞经过改良腺相关病毒生产能力而衍生出的亚克隆细胞系。野生型AAV 基 因组由病毒rep 和cap 基因(分别编码AAV复制和包装相关的基因)及位于两侧的表 达和包装必须的顺式作用元件——反向末端重复序列(Inverted Terminal Repeats, ITRs)组成。在AAV Helper-Free System中,rep 和cap 基因从病毒载体中被转移到辅 助质粒pAAV-RC 中,AAV ITRs 仍位于病毒载体中。在辅助质粒的帮助下,仅需两端 的ITR 就能将携带的外源片段包装进入腺相关病毒颗粒,因此,rep 和cap 基因的转移 后空出的位置是允许外源基因插入病毒基因组中的最大限度。由于不再需要活的辅助 病毒,AAV Helper-Free System 提供一个更安全,更便利的替代逆转录病毒和腺病毒的基因传递系统。
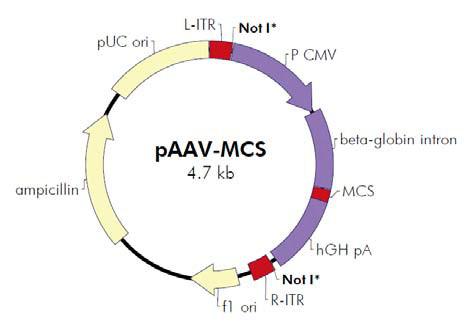
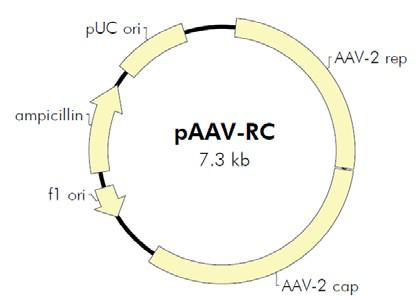
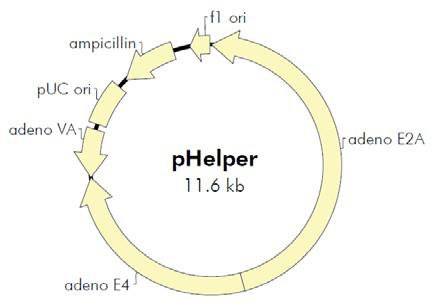
图b. AAV Helper-Free System腺相关病毒系统
三、重组腺相关病毒载体不同血清型
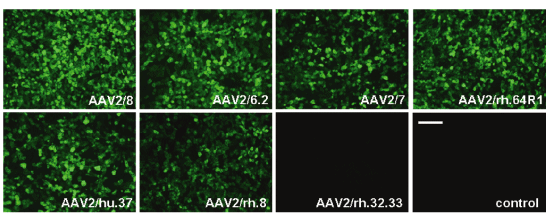
研究发现 AAV 具有多种血清型,各种不同血清型的 AAV 载体的主要区别是 衣壳蛋白不同,因此对不同的组织和细胞的转染效率存在差异。目前靖瑞百康生物在包装腺相关病毒时只有AAV2的 血清型可供客户选择,其他针对 不同 组织器官相应血清型的 AAV 病毒,
见表 1。
血清型 组织亲和性
AAV1 肌肉,心脏,骨骼肌(包括心肌),神经组织
AAV2 中枢神经,肌肉,肝脏,脑组织,眼, AAV3肌肉,肝脏,肺,眼
AAV4 中枢神经,肌肉,眼,脑
AAV5 肺,眼,中枢神经,关节滑膜,胰腺
AAV6 肺,心脏
AAV7 肌肉,肝脏
AAV8 肝脏,眼,中枢神经,肌肉
AAV9 心脏,肌肉,肺(肺泡),肝脏,中枢神经
表1. 不同血清型AAV对各组织器官细胞的亲和性
|
Cell Line
|
AAV-1
|
AAV-2
|
AAV-3
|
AAV-4
|
AAV-5
|
AAV-6
|
AAV-8
|
AAV-9
|
AAV-DJ
|
AAV-DJ/8
|
|
Huh-7
|
13
|
100
|
2.5
|
0
|
0.1
|
10
|
0.7
|
0
|
500
|
0.2
|
|
HEK293
|
25
|
100
|
2.5
|
0.1
|
0.1
|
5
|
0.7
|
0.1
|
500
|
0.3
|
|
HeLa
|
3
|
100
|
2
|
0.1
|
6.7
|
1
|
0.2
|
0.1
|
667
|
0.2
|
|
HepG2
|
3
|
100
|
16.7
|
0.3
|
1.7
|
5
|
0.3
|
ND
|
1250
|
0.5
|
|
Hep1A
|
20
|
100
|
0.2
|
1
|
0.1
|
1
|
0.2
|
0
|
400
|
0.1
|
|
911
|
17
|
100
|
11
|
0.2
|
0.1
|
17
|
0.1
|
ND
|
500
|
0
|
|
CHO
|
100
|
100
|
14
|
1.4
|
333
|
50
|
10
|
1
|
25000
|
5
|
|
COS
|
33
|
100
|
33
|
3.3
|
5
|
14
|
2
|
0.5
|
500
|
0.3
|
|
MeWo
|
10
|
100
|
20
|
0.3
|
6.7
|
10
|
1
|
0.2
|
2857
|
1
|
|
NIH3T3
|
10
|
100
|
2.9
|
2.9
|
0.3
|
10
|
0.3
|
ND
|
500
|
0.1
|
|
A549
|
14
|
100
|
20
|
ND
|
0.5
|
10
|
0.5
|
0.1
|
1000
|
0.1
|
|
HT1180
|
20
|
100
|
10
|
0.1
|
0.3
|
33
|
0.5
|
0.1
|
333
|
0.2
|
|
Monocytes
|
1111
|
100
|
ND
|
ND
|
125
|
1429
|
ND
|
ND
|
100
|
ND
|
|
Immature DC
|
2500
|
100
|
ND
|
ND
|
222
|
2857
|
ND
|
ND
|
200
|
ND
|
|
Mature DC
|
2222
|
100
|
ND
|
ND
|
333
|
3333
|
ND
|
ND
|
100
|
ND
|
表 2. 不同血清型 AAV 感染体外培养细胞比较
四、AAV病毒包装
(一) AAV-293细胞的冻存随着传代的次数增加,AAV-293 细胞会出现生长状态下降、突变等。为了防止 此类现象的出现,我们需要在开始就对细胞进行大量冻存,以保证实验的稳定性和持 续性。在细胞对数生长期进行冻存,增加细胞复苏成活率。
1、去掉细胞培养上清液,加入PBS 洗去残留的培养基;
2、加入0.25%的胰酶,消化1~2min 后,镜下观察细胞变圆,细胞间间隙加大 时,去除胰酶,加入新鲜培养基吹打混匀,移入离心管中。
3、细胞计数,将细胞全部晃下,加入 3mL 37 ℃ 预热的 10% DMEM,用 10mL 移液管进行吹打,较大力吹打 6-8 次即可,不留死角,之后,将所有细胞吸出,置于 15mL 离心管中,取 50ul 混匀后的细胞于 1.5mL eppendorf 管中,加入 450ul 10% DMEM,即为 10 倍稀释,混匀,取 10ul 细胞于计数板中计数。计数板上共 4 大格, 每大格 16 小格。计数时,4 大格均计数,总数除以 4(得每大格细胞数),再乘以 10(10 倍稀释),即为实际 n 万/mL 细胞浓度。
4、细胞离心,1000 rpm/min,5min。去掉上清。
5、根据细胞计数结果加入细胞冻存液(70%完全培养基+20%FBS+10%DMSO)重悬细胞,密度为3 x 106 个/ml。
6、分装进细胞冻存管,放入冻存盒中,放入-80℃超低温冰箱。
7、第二天将细胞放于液氮罐中长久保存,并作记录。保存过程中,要不时复苏 细胞检测细胞存活率,观察细胞状态等。
(二)AAV-293 细胞的传代当细胞生长到汇合率达到 80%~90%时需要对细胞进行传代操作,以扩大细胞数 量,维持细胞良好的生长状态。
1、消化细胞,方法同细胞冻存。
2、细胞离心结束后,加入完全培养基重悬。
3、根据具体情况,将细胞分到10cm 培养皿中,每个培养皿补足到10ml 培养 基。
(三)AAV-293 细胞的复苏 当细胞传代次数过多,细胞状态变差时,或者细胞出现污染事故时,需要丢弃并对最初冻存的细胞进行复苏。
1、设置温度为37~42℃的水浴。
2、查看细胞库记录,根据记录从液氮罐中取出冻存的细胞(需戴上棉手套,防 止被冻伤),迅速丢入水浴锅中并快速晃动,尽量在1~2min 内使细胞溶液完全 溶解。
3、将细胞溶液转移到15ml 离心管中,并在其中加上1ml 新鲜的完全培养基,混 匀后离心,1000 rpm/min,5min。
4、去掉上清,加入5ml 新鲜的完全培养基,混匀沉淀后,转入6 cm 培养皿。
5、将培养皿平稳放入37℃、5% CO2 和95%相对湿度的培养箱中培养。
6、第二天观察细胞存活率。给细胞换一下培养基。以后每天观察细胞生长情 况。
(四)AAV包装和浓缩
1. 质粒扩增构建好的AAV载体、包装质粒和辅助质粒需经过大量抽提, 浓度大于1ug/ul, A260/280 在1.7-1.8 间方可用以包毒。推荐使用Qiagen 大抽试剂盒进行质粒的大量去 内毒素抽提。
2. 传AAV-293细胞将培养AAV-293 细胞T75 瓶中的培养基吸净,加入2mL 4 度冰箱取出的0.25%胰酶,使其均匀覆盖瓶底,置于37 度培养箱中3-5min,取出,摇晃可发现细胞于底部脱 离,将其全部晃下,加入3mL 37 度水浴中预热的10% DMEM,移液枪用10mL 移液 管进行吹打,较大力吹打6-8 次即可,不留死角,瓶口处较难吹打可将移液管对准培 口,小力将培养基打出即可覆盖到接近瓶口的细胞。之后,将所有细胞吸出,置于 15mL 离心管中,取50ul 混匀后的细胞于1.5mL eppendorf 管中,加入450ul 10% DMEM,即为10 倍稀释,混匀,取10ul 细胞于计数板中计数。计数板上共4 大格,每 大格16 小格。计数时,4 大格均计数,总数除以4(得每大格细胞数),再乘以10(10 倍稀释),即为实际n 万/mL 细胞浓度。传代当天记为第一天,若第二天进行转 染,铺900-1000 万/T75;若第三天转染,铺350-400 万/T75。每瓶T75 加10mL 10% DMEM 培养基。转染当天观察细胞密度,80-90%满即可进行转染。转染前无需换培 养基。
3. 做脂转complex
|
试剂名称
|
试剂数量
|
|
载体质粒
|
5ul(1.0ug/ul)
|
|
包装质粒
|
5ul(1.0ug/ul)
|
|
辅助质粒
|
5ul(1.0ug/ul)
|
注:Lipo 2000TM转染试剂为invitrogen产品,使用说明参考Lipo 2000TM说明书。
4. AAV 病毒收毒: 病毒颗粒同时存在于包装细胞和培养上清中。可以将细胞和培养上清都收集下来以获得最好的收率。
1) 准备一个干冰乙醇浴(将乙醇倾入装有干冰的泡沫盒即可,也可用液氮替代干 冰乙醇浴)和37°C 水浴;
2) 将产毒的细胞连同培养基一同收集到一个15ml 的离心管中。收集细胞时,将 培养盘倾斜一定角度将细胞刮到培养基中;
3) 1000 rpm/min,离心3 分钟,分离细胞和上清,将上清另外存放,细胞用1ml PBS 重悬;
4) 将细胞悬浮液在干冰乙醇浴和37°C 水浴中反复转移,冻融四次。每次融解后 稍加震荡。注意:每次凝固和解冻大概需要十分钟的时间。
5. AAV 病毒浓缩:
1) 10,000 g 离心去除细胞碎片,将离心上清转移到一个新离心管中。
2) 将两次收集的上清混合在一起,用 0.45um 滤器过滤除杂质
3) 加入 1/2 体积的 1M NaCl,10% PEG8000 溶液,混合均匀,4度过夜
4) 12,000 rpm 离心 2h,弃上清,病毒沉淀用适量的 PBS 溶液溶解,待完全溶解 后 用 0.22um 滤器过滤除菌。
5) 加入 Benzonase 核酸酶消化去除残留的质粒DNA(终浓度为50 U/ml)。合上 管盖,颠倒几次以充分混合。在37 °C 孵育30 分钟;
6) 用 0.45 μm 过滤头过滤,取滤出液,即为浓缩的AAV病毒。
6. AAV的纯化
1) 向病毒浓缩液中添加固体 CsCl 直到密度为1.41 g/ml(折射率为1.372);
2) 将样品加入到超速离心管中,用预先配好的 1.41 g/ml CsCl 溶液将离心管剩 余空间填满;
3) 在 175,000 g 下离心24 小时,以形成密度梯度。按顺序分步收集不同密度的 样品,取样进行滴度测定。收集富集有AAV 颗粒的组分;
4) 重复上述过程一次。
5)将病毒装入100 kDa的透析袋,4度透析脱盐过夜。此即为纯化的AAV病毒
五、AAV病毒包装滴度测定(采用Q-PCR法)
1)取20ul 浓缩病毒液,加入1ul RNAse-free DNAse,混匀,37℃水浴反应 30min。
2)4℃,12 000 rpm/min,离心10 min,取10ul 上清到另一个无菌的1.5ml EP 管 中。
3)加入90ul Dilution Buffer(1 mM Tris-HCl, pH 8.0,0.1 mM EDTA,150 mM NaCl),混匀,37℃金属浴反应30min。
4)自然冷却至室温,加入1ul 蛋白酶K,65℃水浴反应1h。
5)100℃金属浴反应10min,自然冷却至室温。
6)进行Q-PCR 检测滴度。
六、AAV病毒的储存、稀释
1. 病毒的储存: 收到病毒液后在很短时间内即使用腺相关病毒进行实验,可以将病毒暂时放置于4℃保存;如需长期保存请放置于-80℃(病毒置于冻存管,并 使用封口膜封口)。
1)病毒可以存放于-80℃ 6 个月以上;但如果病毒储存时间超过 6个月,建议在使 用前需要重新测定病毒滴度。
2)反复冻融会降低病毒滴度:每次冻融会降低病毒滴度10%;因此在病毒使用 过程中应尽量避免反复冻融,为避免反复冻融,建议收到病毒后 按照每次的 使用量 进行分装。
2. 病毒的稀释: 如果需要稀释病毒,请将病毒取出置于冰浴融解后,使用 PBS 缓冲液或培养目 的细胞无血清培养基(含血清或含双抗不影响病毒感染)。混匀分 装后 4℃保存(请尽量 在三天内用完) 分装后使用。
七、使用安全注意事项
1.病毒操作时最好使用生物安全柜。如果使用普通超净工作台操作病毒,请不 要打开排风机。
2.病毒操作时请穿实验服,带口罩和手套。
3.操作病毒时特别小心不要产生气雾或飞溅。如果操作时超净工作台有病毒污染, 请立即用70%乙醇加1% SDS 溶液擦拭干净。接触过病毒的枪 头、离心管、培养板、 培养液等请用84 消毒液或1% SDS 中浸泡过夜后弃去。
4.用显微镜观察细胞感染情况时应遵从以下步骤:拧紧培养瓶或盖紧培养板。 用70%乙醇清理培养瓶外壁后到显微镜处观察拍照。离开显微镜实验 台之前,用70% 乙醇清理显微镜实验台。
5.如需要离心,应使用密封性好的离心管,或者用封口膜封口后离心,而且尽 量使用组织培养室内的离心机。 6.脱掉手套后,用肥皂和水清洗双 手。
八、AAV使用案例
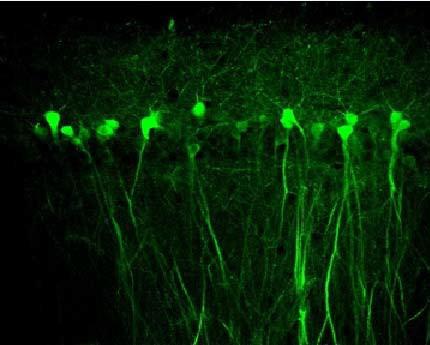
1. AAV2感染大鼠脑组织
2. AAV2感染肾脏
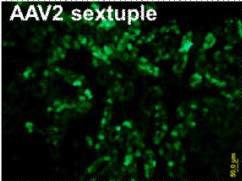 5. AAV感染肝脏
5. AAV感染肝脏